近日,国际微生物学权威期刊PLOS Pathogens在线发表了我校杀菌剂生物学团队周明国和张峰教授为通讯作者、周俞辛博士研究生为第一作者的最新研究成果《Structural basis of Fusariummyosin I inhibition byphenamacril》。这是南京农业大学杀菌剂生物学团队在获得2018年国家科学技术进步二等奖成果的基础上取得的又一新进展。
在近140年的现代杀菌剂发展史上,人类先后研发了400多种杀菌剂用于植物病害的化学防控,而目前探明这些杀菌剂作用的分子靶标或受体蛋白只有20多种,其中具有重要杀菌剂研发利用价值的杀菌剂分子靶标则屈指可数。由于丝状真菌的药敏性蛋白含量极低无法直接提取,对其的分离纯化和结构解析存在许多技术障碍,至今未见有关植物病原丝状真菌药剂受体蛋白三维结构的研究报道,严重阻碍了基于靶标结构的杀菌剂创新发展。
我校杀菌剂生物学团队参与江苏省农药研究所自主创制的镰刀菌专化性杀菌剂氰烯菌酯,代表了人类追求安全、高效的选择性杀菌剂发展方向,并采用现代生物学技术,团队发现了氰烯菌酯的作用靶标肌球蛋白-5(I型),这也是杀菌剂发展史上继发现酶蛋白和骨架蛋白后,国际上发现的第三类马达蛋白首个杀菌剂新靶标,并指出肌球蛋白的遗传分化是其抑制剂的选择性基础,同时研发了小麦赤霉病和水稻恶苗病高效、安全防控及抗药性治理系列新技术。
揭示杀菌剂作用靶标蛋白结构及其与小分子化合物亲和互作的精细结构特征,是发展颠覆性靶向杀菌剂的重要前提。杀菌剂生物学团队张峰教授利用先进的结构生物学方法,在解析了茉莉酸诱导植物抗病性的受体蛋白JAZ通过结构转换控制植物免疫与脱敏反应的机制基础上(Nature, 2015; PNAS, 2017),参与并指导研究生开展了氰烯菌酯与其作用靶标肌球蛋白-5的复合物三维结构研究,首次获得小麦赤霉病菌肌球蛋白分辨率为2.65 Å的晶体结构(PDBID:6UI4),揭示了植物病原丝状真菌肌球蛋白与其抑制剂的互作特征。研究发现氰烯菌酯结合在肌球蛋白马达结构域一个新的变构腔中(图1),该位点与哺乳动物肌球蛋白抑制剂Blebbistatin结合在II型肌球蛋白马达结构域疏水口袋的位置非常接近(图2),表明氰烯菌酯与Blebbistatin可能存在相同的氨基酸结合位点。
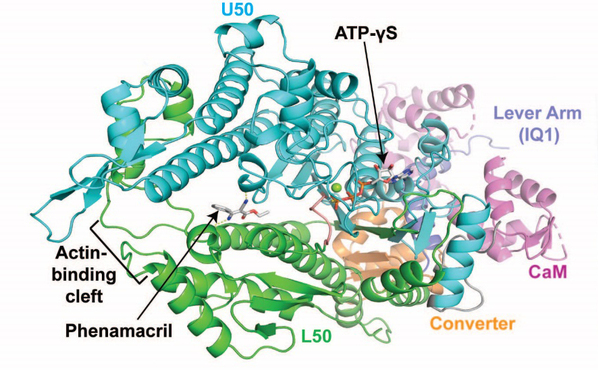
图1 氰烯菌酯与禾谷镰刀菌肌球蛋白-5复合物的晶体三维结构
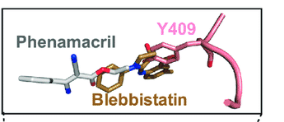
图2 氰烯菌酯和Blebbistatin与肌球蛋白Y409位点互作比较
研究揭示了氰烯菌酯抑制肌球蛋白ATP酶活性的分子机制(图3)。氰烯菌酯结合的变构腔顶部也是与肌动蛋白(F-actin)结合的裂隙(图1),在肌球蛋白的ATP酶循环中,该裂隙会特征性地闭合和开启以介导与肌动蛋白的结合,释放Pi和ADP,完成ATP酶循环。晶体结构(图3A)清楚的显示了小分子氰烯菌酯占据了该裂隙关闭的空间位置,与Switch II 的Y409位点互作阻止了Switch II loop结构从开放裂隙向关闭裂隙的转变,阻断了Pi的释放和肌动蛋白的动力冲程,从而干扰了肌球蛋白ATP酶的循环过程,抑制了蛋白的马达作用。基于三维结构,研究还发现了新的与氰烯菌酯结合的氨基酸位点,并证明其中重要的氨基酸位点M375在不同真菌中的遗传分化决定了肌球蛋白对氰烯菌酯的敏感性(图4),氰烯菌酯对禾谷镰刀菌M375K突变体肌球蛋白-5 的ATP酶活性抑制作用大幅降低,而将对氰烯菌酯不敏感的稻瘟菌肌球蛋白-5突变为K375M后,氰烯菌酯则能强烈抑制该稻瘟菌突变体的肌球蛋白ATP酶活性,同时稻瘟菌K375M突变体对氰烯菌酯变为高度敏感(图4B)。提出了针对肌球蛋白K375设计对稻瘟病菌等具有高活性的新型广谱肌球蛋白抑制剂的可能性。
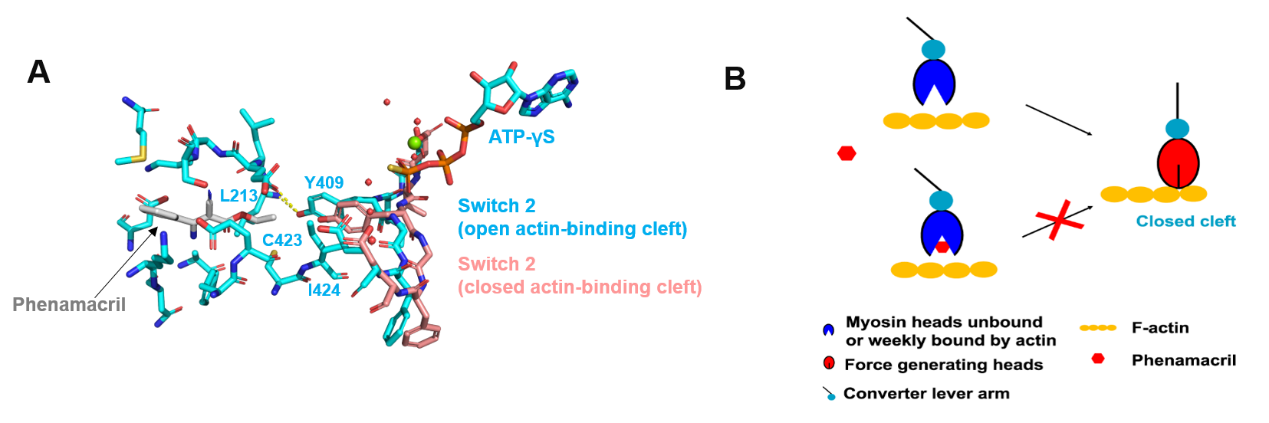
图3 氰烯菌酯对肌球蛋白的抑制机制及模式图
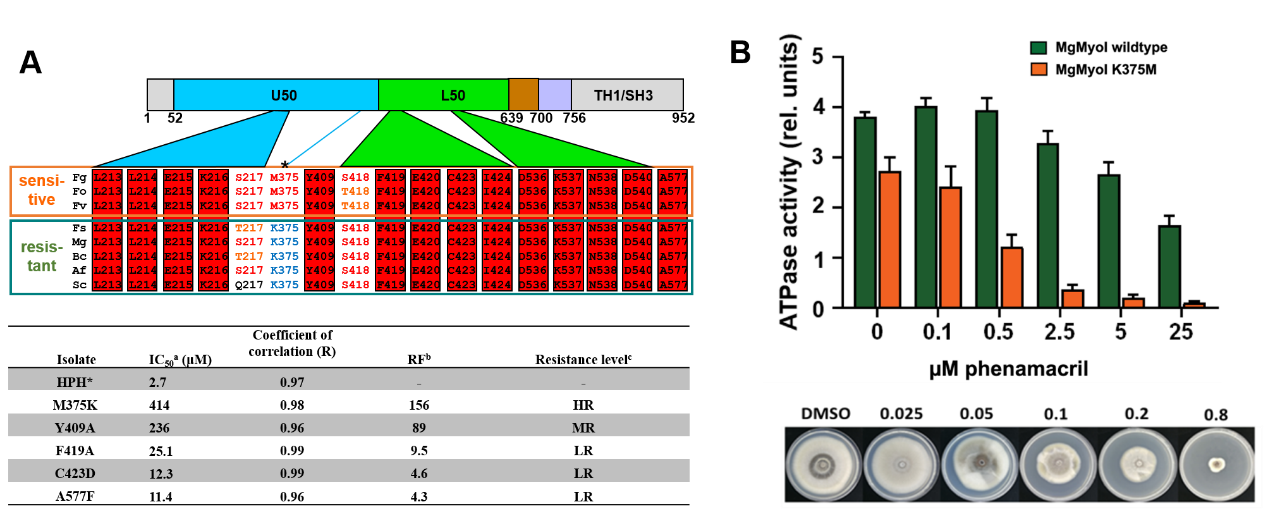
图4 植物病原真菌I型肌球蛋白关键氨基酸对氰烯菌酯的敏感性
团队的以上创新性研究为肌球蛋白抑制剂的创制发展奠定了重要的科学基础。该研究解析的杀菌剂与靶标复合物晶体三维结构是首个直接针对病原物研究的科学探索成功案例,对于推动农业有害生物的农药受体结构生物学研究和靶向农药创制具有引领性作用。
该研究还得到美国温安诺研究所Karsten Melcher研究员和X. EdwardZhou的指导并提供了相关研究条件,同时还得到了美国西北大学、中国科学院上海药物研究所等同行的支持和帮助。此项工作得到了国家自然科学基金项目等的经费支持,博士研究生周俞辛得到了国家留学基金委联合培养项目和学校短期出国交流项目的资金支持。
刊发论文链接:
Structural basis of Fusariummyosin I inhibition by phenamacril. PLoS Pathogens 2020,16(3):e1008323
https://doi.org/10.1371/journal.ppat.1008323




