我们人体内具有一个很酷的时钟——生物钟,它由基因和蛋白质打造,是生物进化的礼物。生物钟掌控着我们每天生活的节奏:什么时候安然入睡,什么时候精神饱满地醒来。长期的生物钟紊乱可导致糖尿病、高血脂、肥胖等代谢性疾病,甚至癌症。2017年的诺贝尔生理医学奖授予生物钟研究领域的Jeffrey C. Hall, Michael Rosbash, Michael W.Young三位科学家,他们发现了世界上第一个生物钟基因,揭示了细胞控制生物钟的内在机制。然而,生物钟调控生理、代谢和行为等生命活动的机制十分复杂,仍需要进一步深入探究。
近日,南京农业大学动物科技院王恬教授团队与芝加哥大学合作在 Cell 子刊 Cell Reports (IF 8.28)上在线发表题为“Circadian clock regulation of hepatic lipid metabolism by modulation of m6A mRNA methylation”的研究论文。南京农业大学钟翔副教授为论文第一作者及共同通讯作者,南京农业大学为第一通讯单位,芝加哥大学医学院Eugene B Chang教授为第一通讯作者。该团队的王恬教授、余嘉瑶和李毅研究生参与了本项目研究。该研究得到了芝加哥大学ChuanHe教授(HHMI研究员,m6A研究领域的权威科学家)、浙江大学刘建钊教授、武汉大学翁小成教授的支持,并得到了国家自然科学基金、国家留学基金委、江苏省自然科学基金、江苏省优势学科建设、南京农业大学钟山学者学术新秀等的资助。
N6-甲基腺嘌呤(m6A)是真核生物RNA上最丰富的一种转录后修饰,在基因表达、RNA剪切、mRNA运输与翻译等方面均发挥重要的调控作用。动态和可逆的m6A甲基化修饰广泛参与哺乳动物的发育、免疫、肿瘤生成和转移、干细胞更新、脂肪分化等生命过程。在该研究中,我们将小鼠肝脏生物钟基因Bmal1特异性敲除,发现小鼠肝脏脂代谢异常,mRNA的m6A水平升高,并且失去昼夜节律性。通过m6A-seq,我们发现调控肝脏脂代谢的重要基因PPARα的m6A修饰升高,提示Bmal1影响m6A RNA甲基化修饰进而调控脂代谢相关基因的表达从而调节脂代谢。进一步研究证实,m6A RNA甲基化修饰可通过YTHDF2影响PPARα mRNA的稳定性和寿命,从而调控PPARα基因的转录与翻译,并影响脂代谢。该研究揭示了生物钟调控代谢的新方式,拓展了人们对生物钟、m6ARNA甲基化修饰和代谢相互关系的认识。
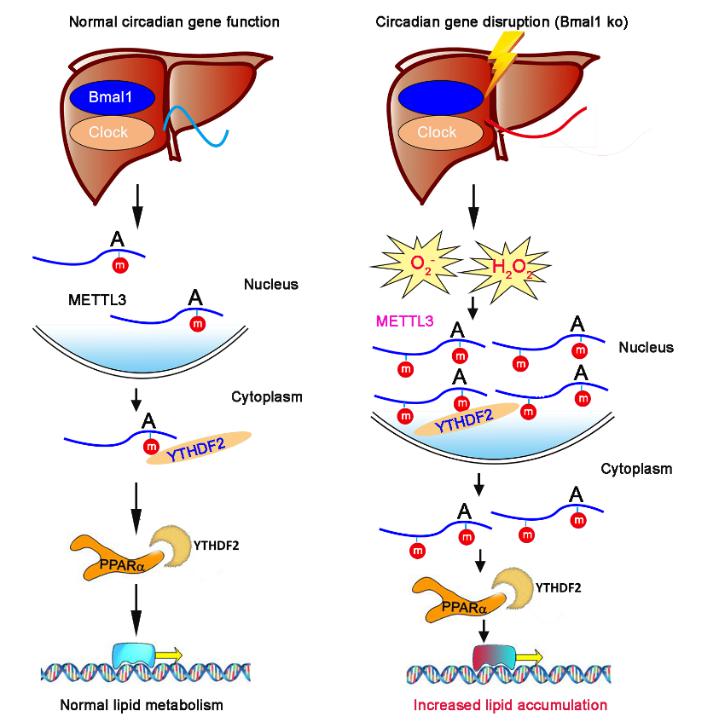
生物钟基于m6ARNA甲基化修饰调控机体代谢




